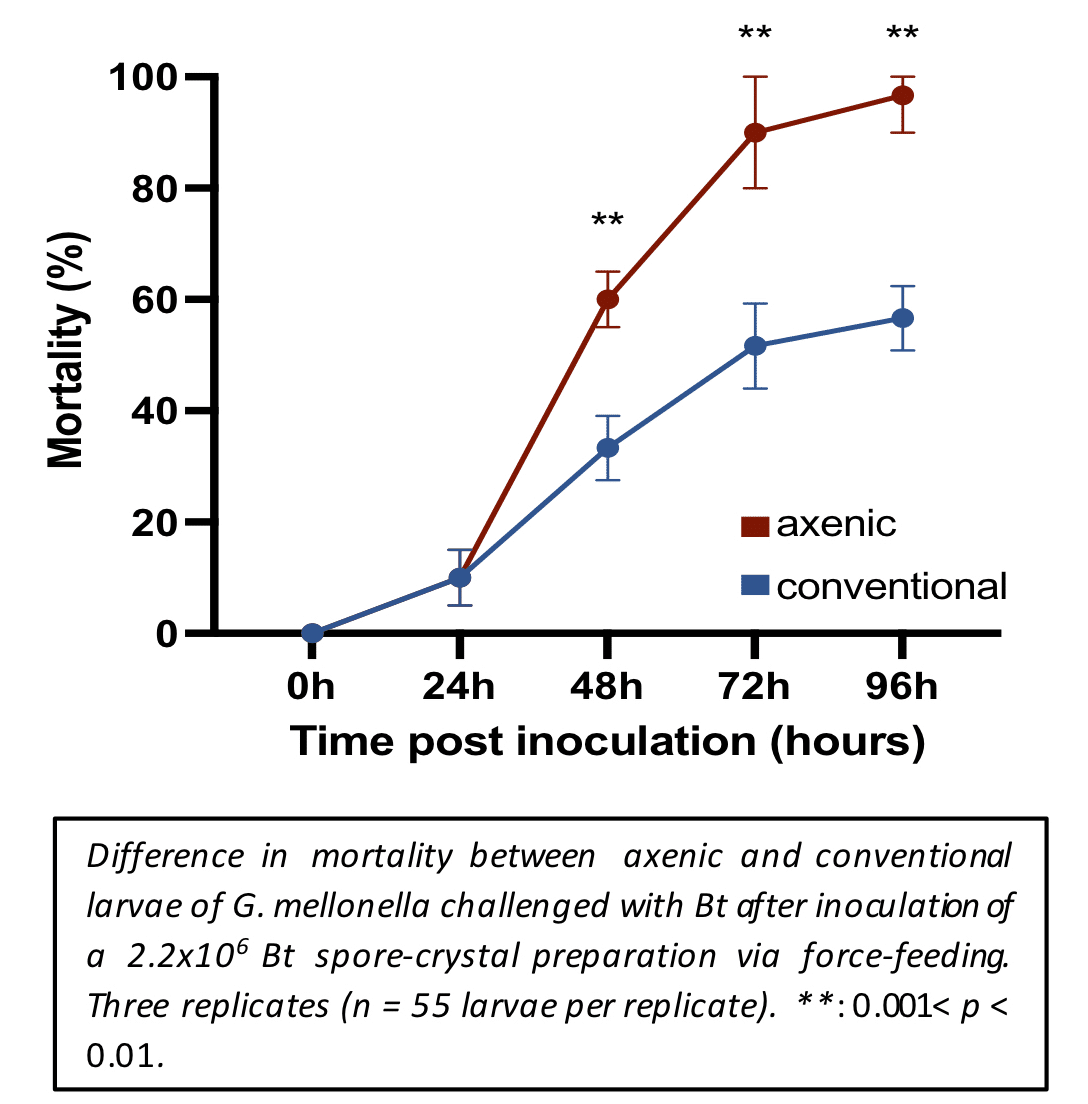
Selected publications since 2018. For an exhaustive list since the creation of the Micalis UMR in 2010, click here
- Savio C, Herren P, Lecocq A, Rejasse A, Rios, Jensen AB, Van Loon JJ and Nielsen-LeRoux C. 2024. Minor impact of probiotic bacteria and egg white on Tenebrio molitor growth, microbial composition and pathogen infection. Front. Insect Sci. doi: 10.3389/finsc.2024.1334526
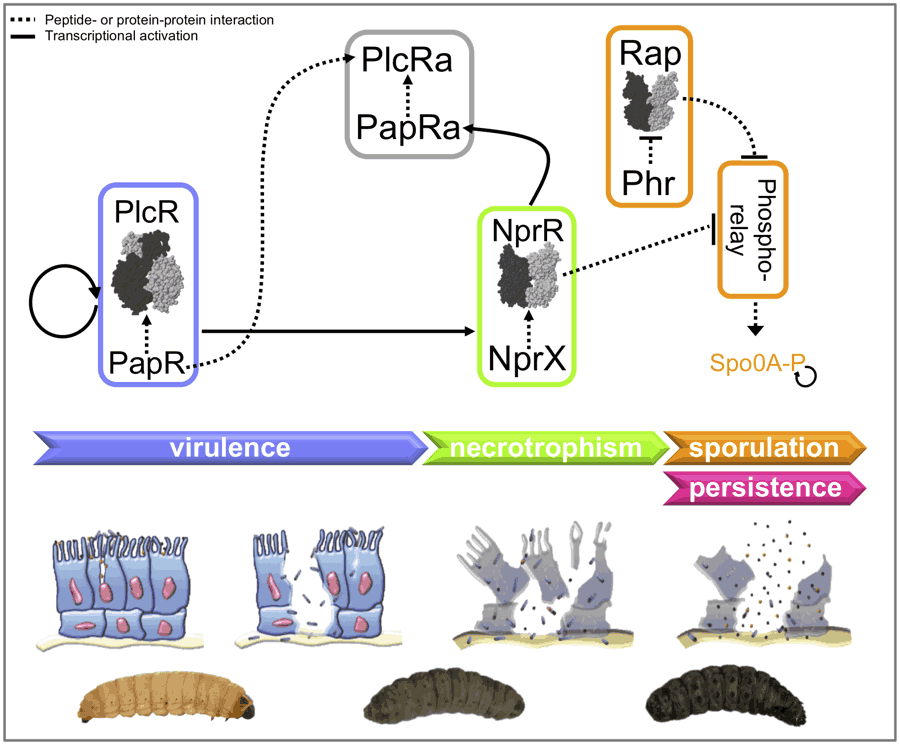
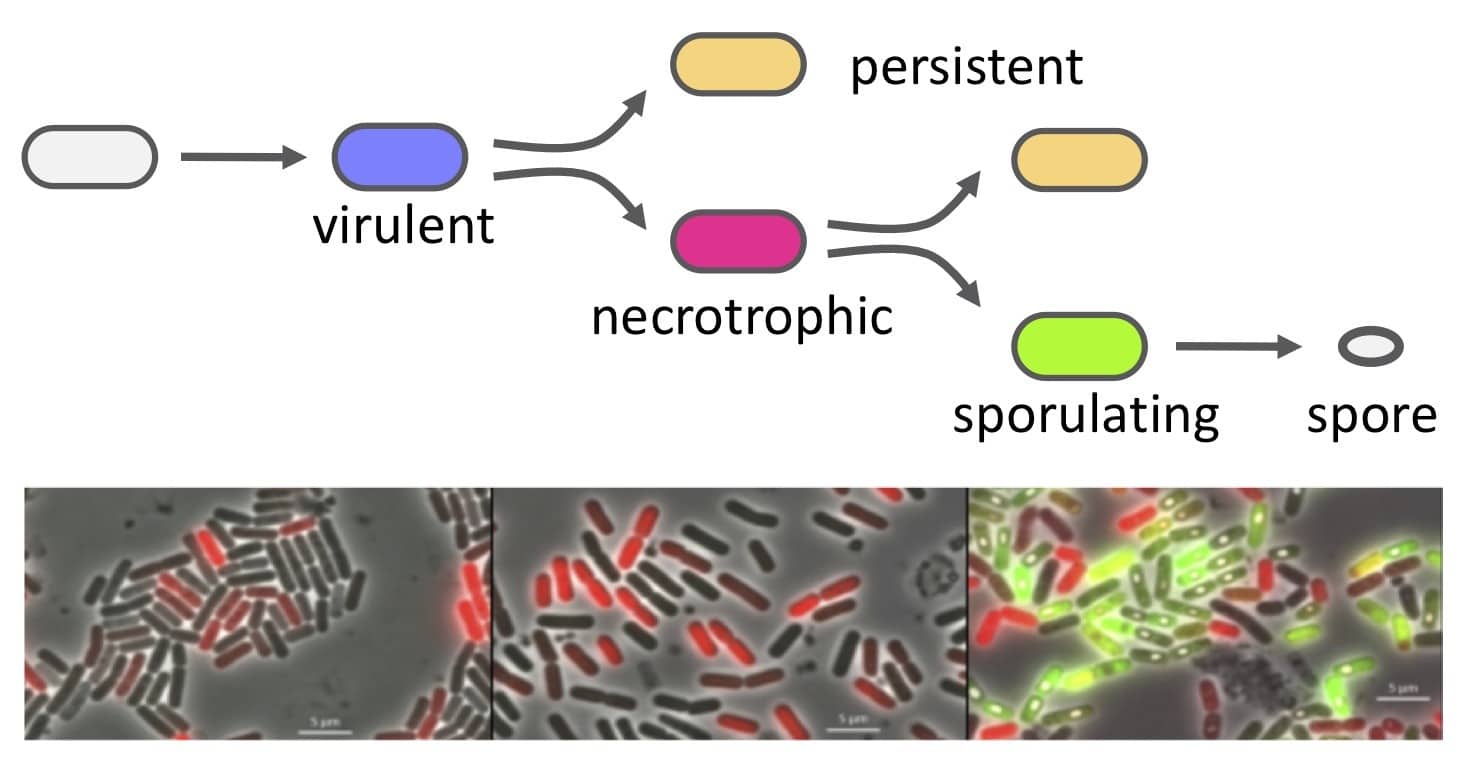
- Toukabri H, Lereclus D, Slamti L. 2023. A sporulation-independent way of life for Bacillus thuringiensis in the late stages of an infection. mBio. doi: 10.1128/mbio.00371-23.
- Upfold J, Rejasse A, Nielsen-LeRoux C, Jensen AB and Sanchis-Borja V. 2023. The immunostimulatory role of an Enterococcus-dominated gut microbiota in host protection against bacterial and fungal pathogens in Galleria mellonella larvae. Front. Insect Sci. doi: 10.3389/finsc.2023.1260333.
- Chen H., Verplaetse E, Slamti L, Lereclus D. 2022. Expression of the Bacillus thuringiensis vip3A insecticidal toxin gene is activated at the onset of stationary phase by VipR, an autoregulated transcription factor. Microbiol Spectr. doi: 10.1128/spectrum.01205-22.
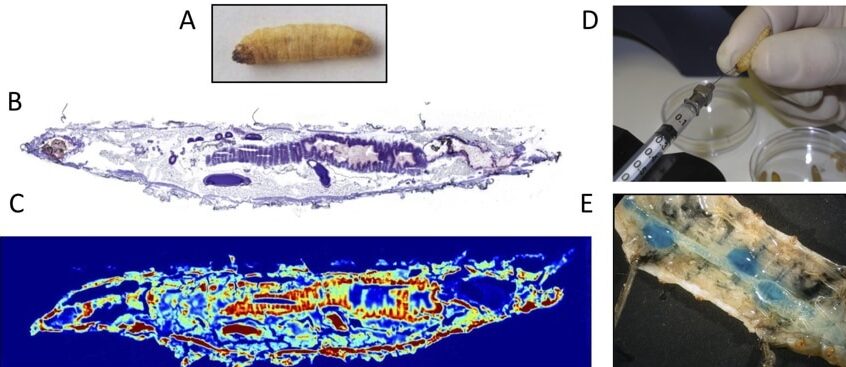
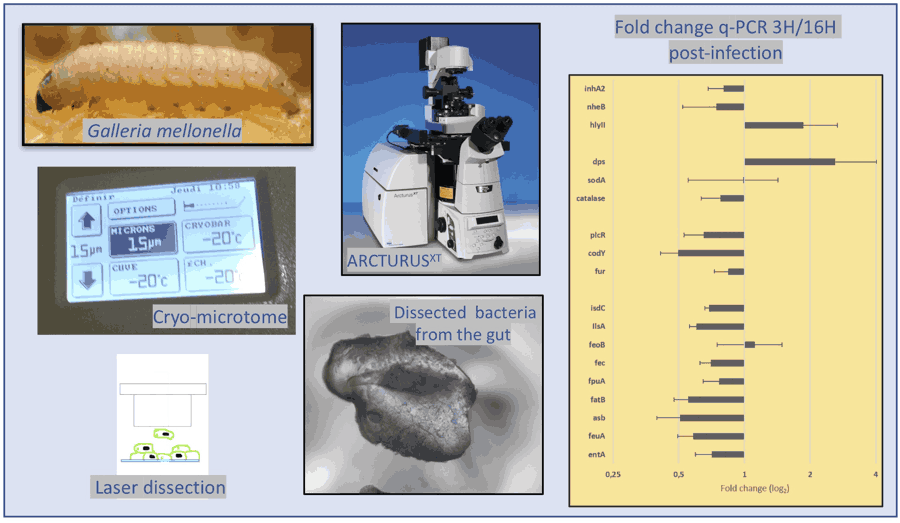
- Consentino L, Rejasse A, Crapart N, Bevilacqua C, Nielsen-LeRoux C. 2021. Laser capture microdissection to study Bacillus cereus iron homeostasis gene expression during Galleria mellonella in vivo gut colonization. Virulence. doi: 10.1080/21505594.
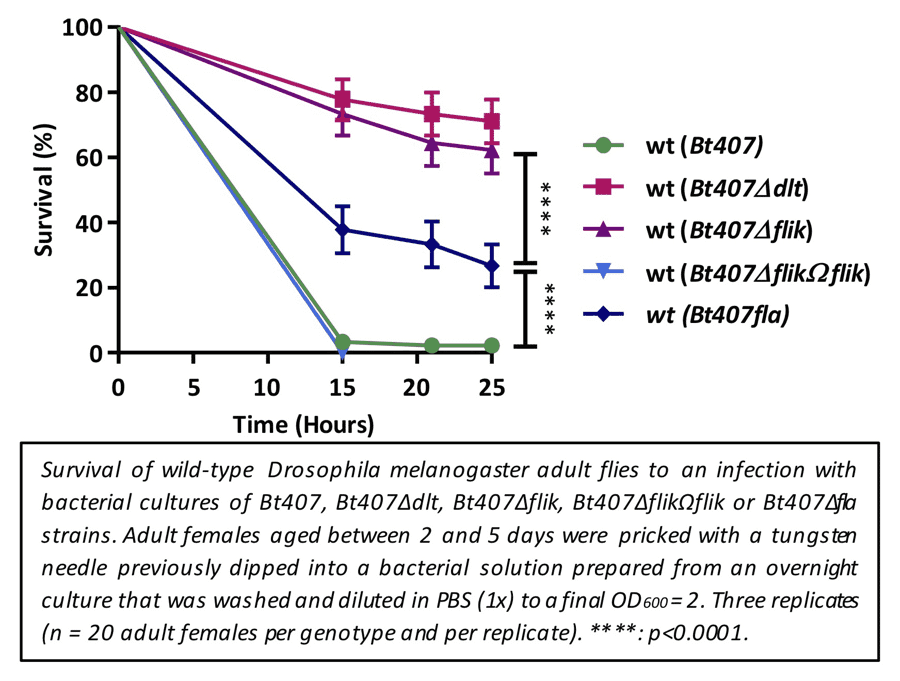
- Attieh Z, Mouawad C, Rejasse A, Jehanno I, Perchat S, Hegna IK, Økstad OA, Kallassy Awad M, Sanchis-Borja V and El Chamy L. 2020. The fliK gene is required for the resistance of Bacillus thuringiensis to antimicrobial peptides and virulence in Drosophila melanogaster. Front. Microbiol. 2020. doi: 10.3389/fmicb.2020.611220.
- Cardoso P, Fazion F, Perchat S, Buisson C, Vilas-Bôas G, Lereclus D. 2020. Rap-Phr Systems from plasmids pAW63 and pHT8-1 act together to regulate sporulation in the Bacillus thuringiensis serovar kurstaki HD73 strain. Appl Environ Microbiol. doi: 10.1128/AEM.01238-20.
- Zhang R, Slamti L, Tong L, Verplaetse E, Ma L, Lemy C, Peng Q, Guo S, Zhang J, Song F, Lereclus D. 2020. The stationary phase regulator CpcR activates cry gene expression in non-sporulating cells of Bacillus thuringiensis. Mol Microbiol. doi: 10.1111/mmi.14439.
- Candela, T., Fagerlund, A., Buisson, C., Gilois, N., Kolstø, A. B., Økstad, O. A. Aymerich S., Nielsen-Leroux C., Lereclus D. and Gohar M. 2019. CalY is a major virulence factor and a biofilm matrix protein. Mol Microbiol. doi: 10.1111/mmi.14184.
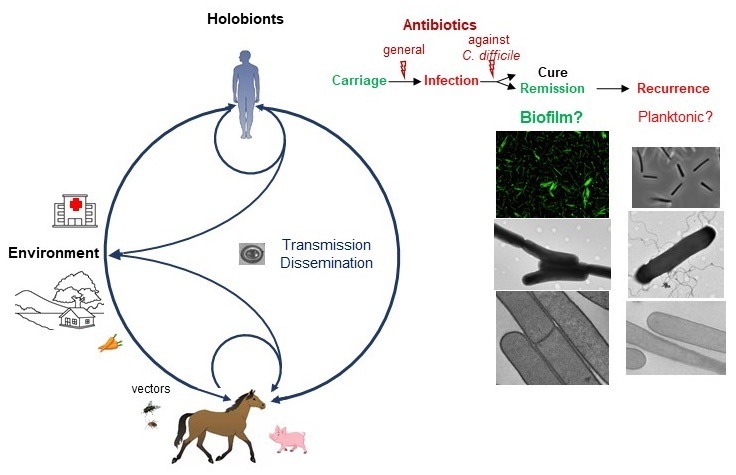
- Poquet I, Saujet L, Canette A, Monot M, Mihajlovic J, Ghigo JM, Soutourina O, Briandet R, Martin-Verstraete I, Dupuy B. 2018. Clostridium difficile biofilm : Remodeling metabolism and cell surface to build a sparse and heterogeneously aggregated architecture. Front. Microbiol. doi: 10.3389/fmicb.2018.02084.

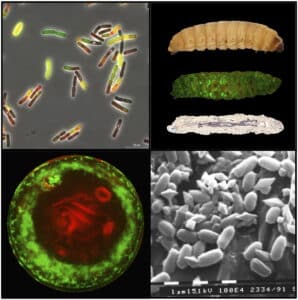

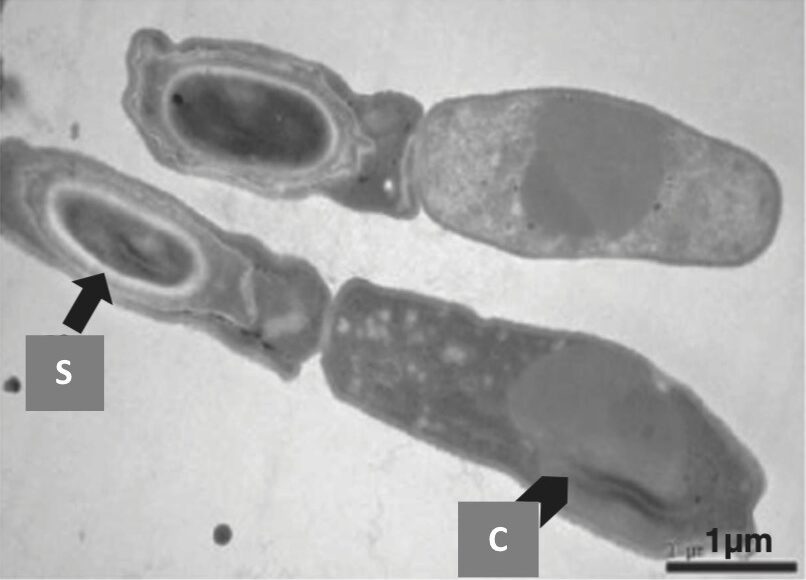
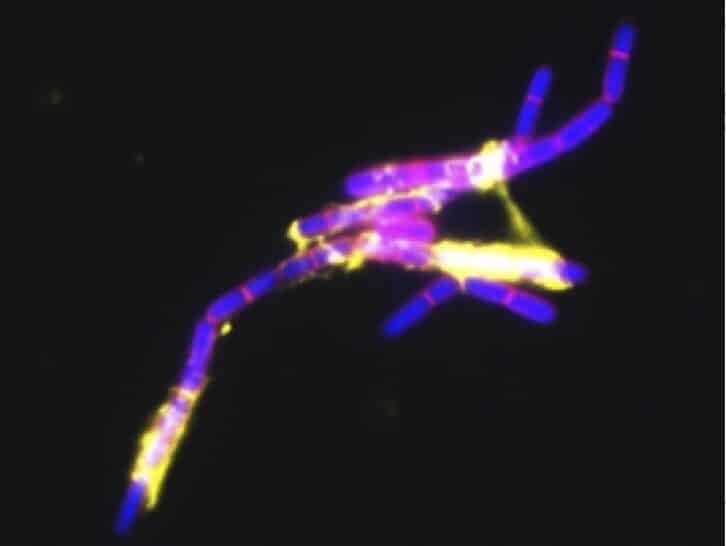
 La plupart des souches émétiques de Bc hébergent un mégaplasmide appelé pCER270. Ce plasmide porte le locus ces impliqué dans la production de la toxine émétique, ainsi que de nombreux gènes de fonction inconnue ou codant pour des régulateurs. Nous avons montré que pCER270 est impliqué dans des phénotypes spécifiques aux souches émétiques, tels que la résistance élevée des spores à la chaleur ou la formation de biofilms atypiques, et nous émettons l’hypothèse que ces phénotypes spécifiques rendent les souches émétiques bien adaptées à l’alimentation humaine et contribuent donc à leur pathogénicité. Par conséquent, le transfert de pCER270 à des souches non pathogènes pourrait entraîner l’émergence de nouveaux pathogènes. Bien que pCER270 ne soit pas un plasmide conjugatif, nous avons réussi à le transférer à Bt et B. weihenstephanensis par un processus de conduction et avons constaté que le transfert du plasmide avait un impact sur le transcriptome du nouvel hôte (doi : 10.1016/j.resmic.2023.104074). Nous avons également constaté que pCER270 a un impact sur la sporulation et la formation de biofilms et nous avons identifié les régulateurs codés par pCER270 impliqués dans les phénotypes induits par pCER270. Nous déterminons actuellement l’effet de pCER270 sur l’aptitude de son hôte dans divers environnements.
La plupart des souches émétiques de Bc hébergent un mégaplasmide appelé pCER270. Ce plasmide porte le locus ces impliqué dans la production de la toxine émétique, ainsi que de nombreux gènes de fonction inconnue ou codant pour des régulateurs. Nous avons montré que pCER270 est impliqué dans des phénotypes spécifiques aux souches émétiques, tels que la résistance élevée des spores à la chaleur ou la formation de biofilms atypiques, et nous émettons l’hypothèse que ces phénotypes spécifiques rendent les souches émétiques bien adaptées à l’alimentation humaine et contribuent donc à leur pathogénicité. Par conséquent, le transfert de pCER270 à des souches non pathogènes pourrait entraîner l’émergence de nouveaux pathogènes. Bien que pCER270 ne soit pas un plasmide conjugatif, nous avons réussi à le transférer à Bt et B. weihenstephanensis par un processus de conduction et avons constaté que le transfert du plasmide avait un impact sur le transcriptome du nouvel hôte (doi : 10.1016/j.resmic.2023.104074). Nous avons également constaté que pCER270 a un impact sur la sporulation et la formation de biofilms et nous avons identifié les régulateurs codés par pCER270 impliqués dans les phénotypes induits par pCER270. Nous déterminons actuellement l’effet de pCER270 sur l’aptitude de son hôte dans divers environnements.