BaPS
Bactéries pathogènes et santé
Notre équipe travaille sur la physiopathologie des infections à Clostridioides difficile, une bactérie à Gram positif anaérobie et sporulée qui est un entéropathogène majeur en santé humaine et animale. C. difficile a été classée comme une menace urgente en termes de résistance aux antibiotiques par le CDC en 2019 (Centers for Disease Control and Prevention (U.S.), 2019). Dans ce contexte, les objectifs de notre équipe sont de mieux comprendre la physiopathologie des infections à C. difficile afin d’identifier des moyens de lutte contre ce pathogène intestinal. Quatre axes de recherche sont actuellement développés pour étudier cette bactérie :
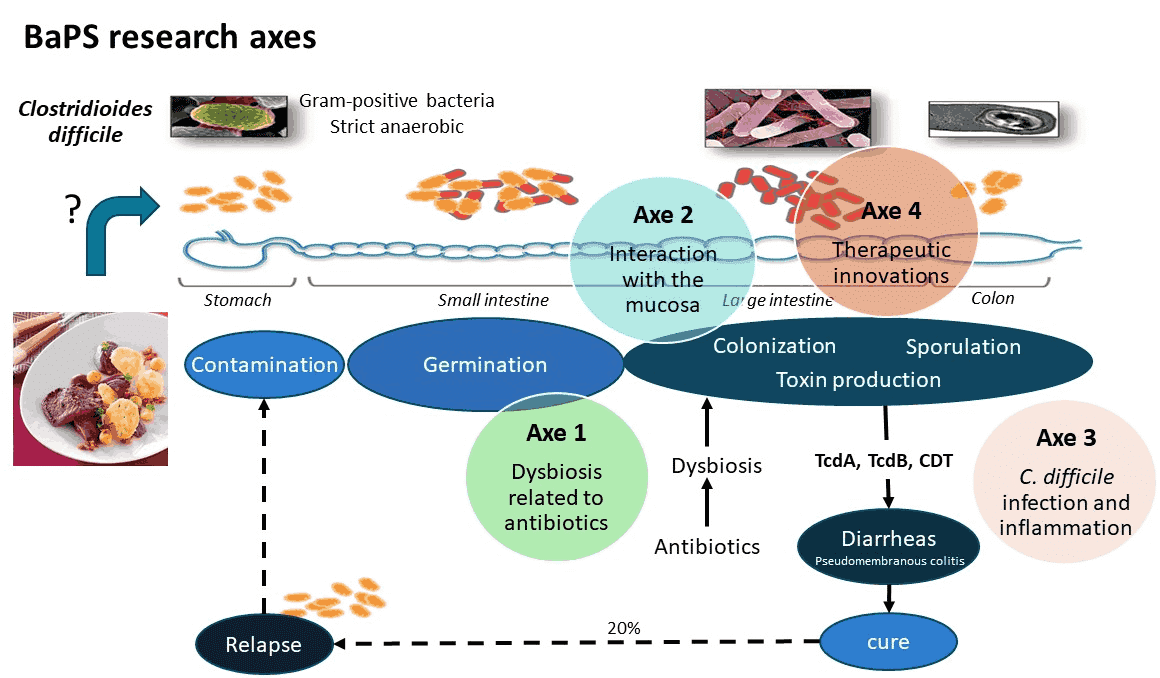
Clostridioides difficile est responsable d’une grande partie des diarrhées post-antibiotiques et de la plupart des colites pseudo-membraneuses chez l’homme, ainsi que de nombreuses infections intestinales chez le bétail. La première étape de l’infection à C. difficile (CDI) correspond à la colonisation de l’hôte. Cette étape est rendue possible par une dysbiose du microbiote, consécutive la plupart du temps à une exposition aux antibiotiques. La rupture de l’effet barrière qui en résulte favorise la germination des spores infectieuses et l’implantation de C. difficile dans sa niche intestinale. Les signes cliniques résultent de l’effet des toxines (principaux facteurs de virulence) sur les cellules et les tissus intestinaux. On sait que l’issue de l’infection est liée à la virulence de la souche mais aussi à l’intensité de la réponse de l’hôte, à la fois innée et adaptative. En effet, la réponse inflammatoire, essentielle pour l’élimination du pathogène, peut également exercer un effet délétère sur l’hôte si elle n’est pas contrôlée. L’ICD est traitée par des antibiotiques mais des infections récurrentes se produisent fréquemment, conduisant chez certains patients à des expériences de récurrences multiples, c’est-à-dire des rechutes la plupart du temps. La persistance de la souche initiale chez le patient, dans un état de colonisation asymptomatique, a longtemps été liée à la production de spores, mais récemment l’hypothèse de la persistance de C. difficile dans un biofilm a également été proposée.
Avec plus de 20 ans de recherche sur C. difficile, notre équipe est reconnue pour avoir une grande expertise sur la pathophysiologie du C. difficile et l’ICD. Nos objectifs sont à la fois d’approfondir les connaissances de base sur les interactions entre C. difficile et l’hôte et d’identifier de nouvelles stratégies pour lutter contre l’ICD. Plusieurs projets ont été développés pour répondre à ces questions : les mécanismes sous-jacents à l’augmentation du risque infectieux suite à une dysbiose du microbiote intestinal ; l’étude de la formation et de l’architecture du biofilm de C. difficile pour comprendre les interactions avec la muqueuse digestive ; la caractérisation de plusieurs composants polymériques importants de la surface bactérienne (e.. flagelles, polysaccharides, peptidoglycane) comme nouvelles cibles pour l’inhibition de C. difficile ; l’étude de la réponse innée (et sa régulation) et adaptative de l’hôte aux facteurs de virulence ; le développement d’innovations thérapeutiques telles que les vaccins muqueux ou les probiotiques. Ces projets sont regroupés en 4 axes thématiques (voir ci-dessous).
Pour mener à bien ces projets, l’unité comprend actuellement, en tant que personnel permanent, 12 enseignants-chercheurs, 2 techniciens (recherche et enseignement) et une secrétaire. Un troisième technicien (recherche et enseignement) et un aide de laboratoire sont présents en tant que contrat à durée déterminée rémunéré par la Faculté de pharmacie. Nous encadrons actuellement 3 doctorants, 3 M2, 3 ingénieurs de recherche et un assistant ingénieur sur ressources propres (contrats externes). Nous disposons d’une variété d’outils et d’expertises, dans les bactéries anaérobies, la bactériologie moléculaire et la manipulation génétique des Clostridia, la microbiologie cellulaire, la microbiologie médicale, et les modèles d’ICD chez les rongeurs.
Axe de recherche
Antibiotiques, dysbiose et émergence du risque infectieux (ATB-DRI)
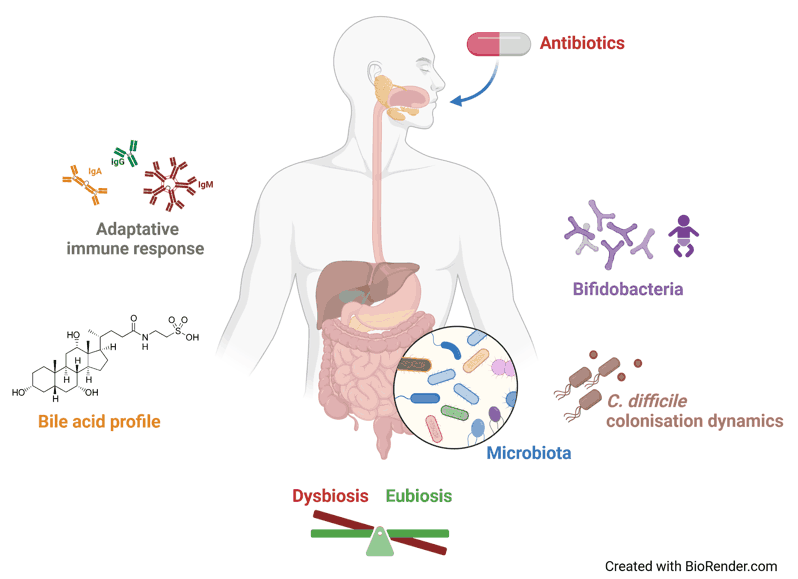
Le groupe ATB-DRI étudie l’impact des antibiotiques, en particulier la dysbiose du microbiote intestinal, sur l’émergence d’infections, en particulier les infections à C. difficile (CDI).
Nous étudions les facteurs qui influencent le processus de colonisation intestinale, la clairance ou la persistance de C. difficile, et comment C. difficile interagit avec les différents microenvironnements digestifs et l’hôte. Nous utilisons un modèle expérimental d’ICD chez la souris et des dispositifs ex vivo, simulant les conditions du tube digestif, pour étudier les signatures microbiennes, le métabolisme des acides biliaires et la réponse immunitaire des muqueuses. Notre projet intègre également une approche translationnelle chez l’homme, avec des collections cliniquement documentées de cohortes d’adultes et de nourrissons, afin de développer des thérapeutiques ciblées et des stratégies de prévention contre l’ICD (impliquant en particulier les espèces de bifidobactéries).
Interaction de C. difficile avec la muqueuse
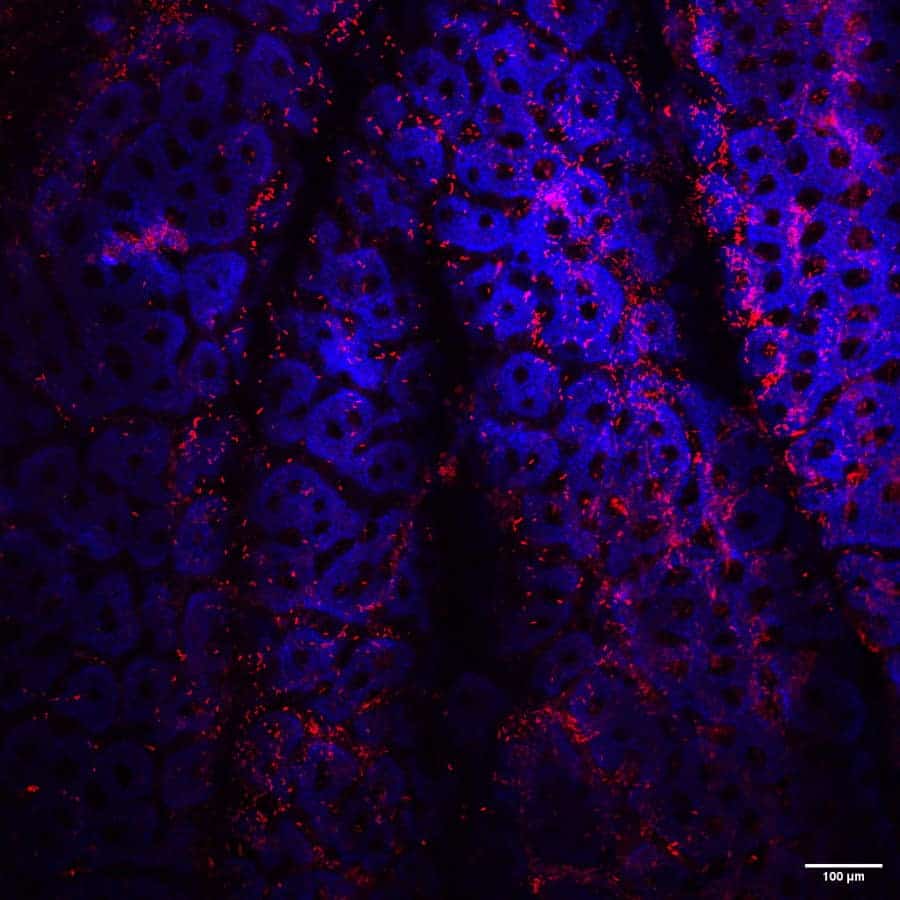
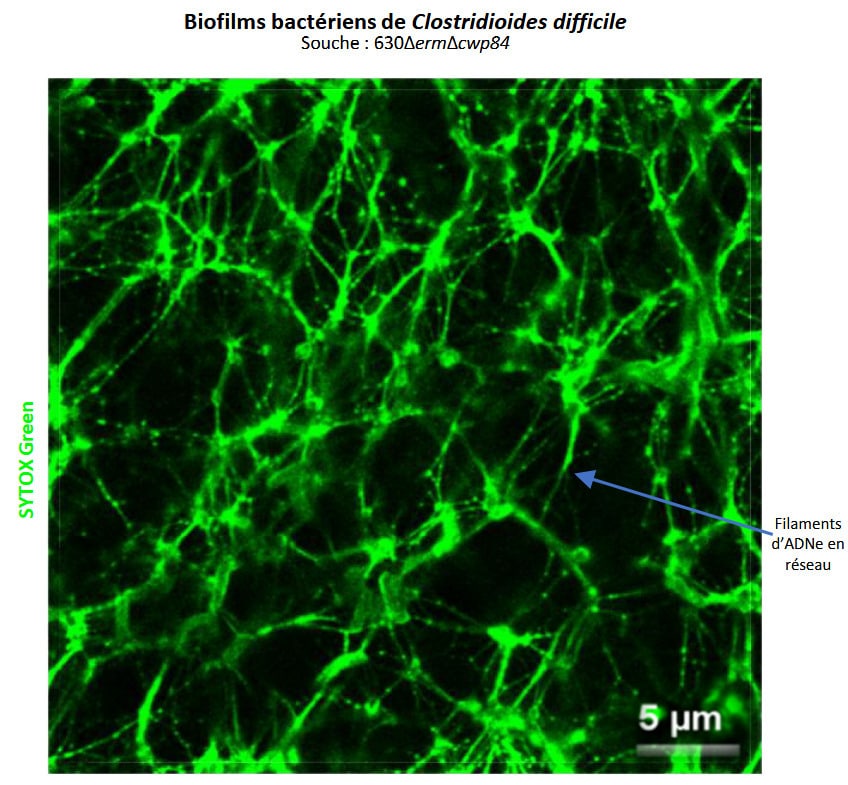
Cet axe se concentre actuellement sur les biofilms formés par C. difficile, à la fois in vitro pour comprendre la production de biofilms et leurs principales caractéristiques, et in vivo, pour explorer le rôle putatif des biofilms de C. difficile dans la survenue des rechutes. In vitro, nous travaillons particulièrement sur le rôle de l’ADN extracellulaire dans la formation et les propriétés du biofilm de C. difficile et sur l’identification de facteurs capables de déclencher la production de biofilm (notamment les concentrations sub-inhibitrices de β-lactamines). In vivo, nous nous intéressons à l’identification de marqueurs de la formation du biofilm. Nous travaillons également sur la formation de biofilms mixtes entre CD et des bactéries commensales spécifiques dans un modèle de souris gnotobiotique.
Infection à C. difficile et inflammation
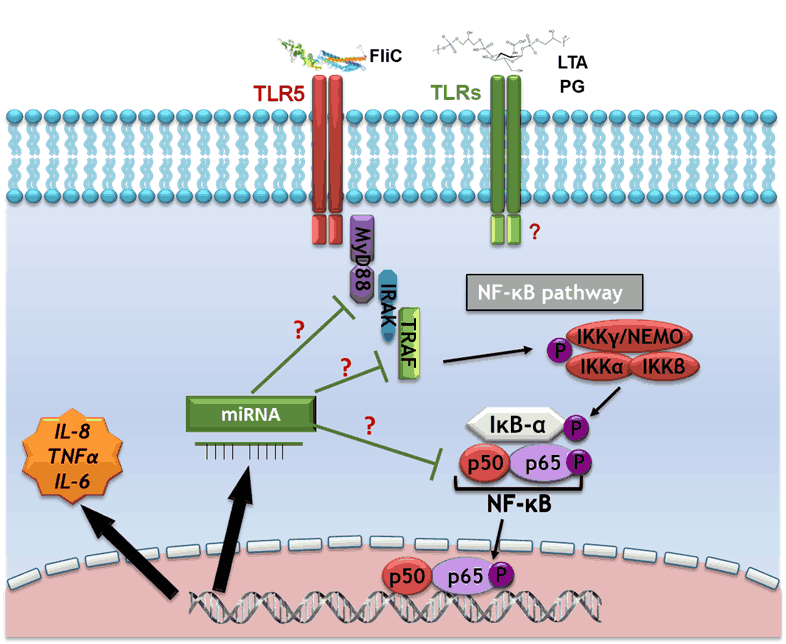
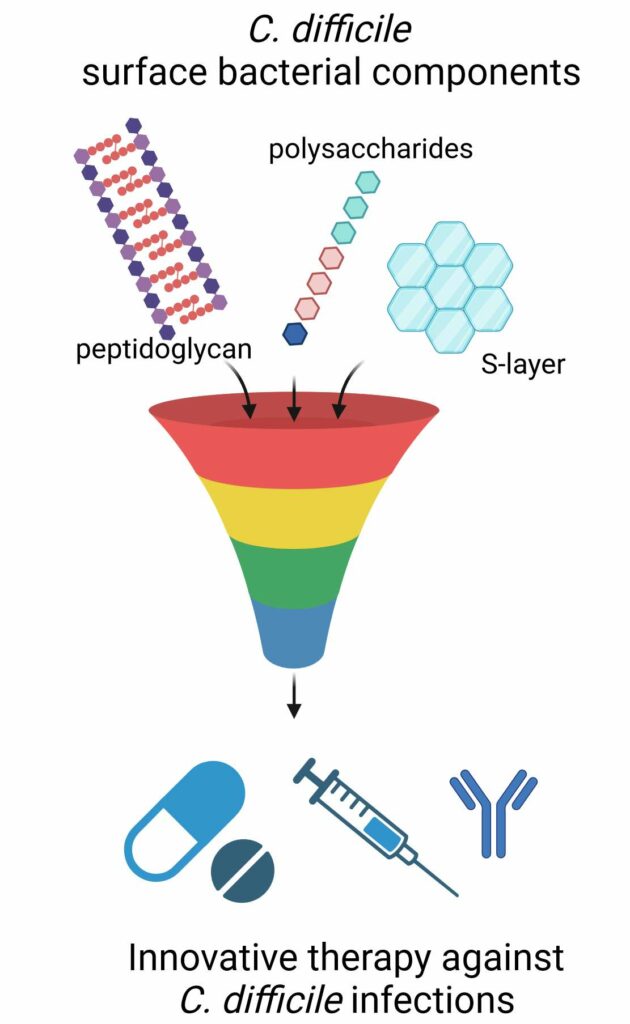
Nous concentrons nos recherches sur les flagelles de C. difficile et d’autres composants de surface de la bactérie, qui peuvent être potentiellement impliqués dans le développement d’une réponse inflammatoire de l’hôte et pourraient constituer de nouvelles cibles thérapeutiques pour les infections à C. difficile. Nous avons démontré que l’interaction TLR5-flagelline déclenche des voies de signalisation impliquant les MAPK et NF-kB, qui sont responsables de la sécrétion de cytokines pro-inflammatoires. Les acides lipoteichoïques et le peptidoglycane de C. difficile pourraient également être impliqués dans la réponse pro-inflammatoire de l’hôte. Les effecteurs des voies de signalisation impliquées dans la réponse de l’hôte contre ces composés et le rôle régulateur pro- ou anti-inflammatoire potentiel des miARN sont actuellement à l’étude.
Innovations thérapeutiques
Membres de l'équipe
Alumni
- Liste à puce
- Liste à puce
- Liste à puce
- Liste à puce
- Liste à puce
- Liste à puce
- Liste à puce
Faits marquants
- Microbiol Spectr 2023 Feb 23;11(2):e0422722. Villemagne et al. Polysaccharide II surface anchoring, the Achilles’ heel of Clostridioides difficile
- Antibiotics 2022 May 5;11(5):624. Doan et al. Impact of Subinhibitory Concentrations of Metronidazole on Morphology, Motility, Biofilm Formation and Colonization of Clostridioides difficile.
- Hosp Infect 2022 Nov:129:65-74. Le Monnier et al. One-day prevalence of asymptomatic carriage of toxigenic and non-toxigenic Clostridioides difficile in 10 French hospitals.
- Front Microbiol 2017 Front Microbiol Oct 25:8:2086. Soavelomandroso et al. Biofilm Structures in a Mono-Associated Mouse Model of Clostridium difficile Infection.
- Sci Rep 7(1): 3256 Batah et al. Clostridium difficile flagella induce a pro-inflammatory response in intestinal epithelium of mice in cooperation with toxins.
- J Hosp Infect 2022 Nov:129:65-74. Le Monnier et al. One-day prevalence of asymptomatic carriage of toxigenic and non-toxigenic Clostridioides difficile in 10 French hospitals.
- Doan et al. 2022 May 5;11(5):624. Impact of Subinhibitory Concentrations of Metronidazole on Morphology, Motility, Biofilm Formation and Colonization of Clostridioides difficile.
Tous les articles de l’équipe sont disponibles dans la collection BAPS-MICALIS sur HAL.
- International patent PCT/EP2015/05725 (in collaboration)
- International Patent PCT/EP2019/080748
- Maturation project SATT Mir, MicroRNA for the treatment of intestinal inflammation, (2021-2024), Coordinator
- POC-in-Lab MIRCa (2023-203), funded by GS HeaDS (IDEX)
- ANR DifKin (ANR-17-CE15-0018): A Serine/threonine kinase promotes resistance to antimicrobial coumpounds crucial during colonization in Clostridium difficile (2018-2021), Partner
- ANR Dalatar (ANR-19-CE18-0008): Targeting D-alanylation of teichoic acids to fight clinically-problematic Gram-positive pathogens (2020-2024), Partner
- ANR DifBioRel (ANR-20-CE15-0022): Exploring biology of biofilm formation by Clostridium difficile and its role in gut persistence and relapse of infection (2021-2025), Partner
- ANR CdiffRib (ANR-22-CE15-0020): Role of RNA-dependent control in the pathophysiology of Clostridioides difficile and its interaction with the host (2023-2026), Partner,
- ANR DifOx (ANR-22-CE15-0026): Effect of exposure to oxygen and oxidative stress on Clostridioides difficile gut colonization and virulence (2023-2026), Partner,
- ANR TympaBiOM (ANR-22-CE52-0006) : Biomatériaux actifs contenant des probiotiques pour la régénération de la membrane tympanique dans l’otite moyenne chronique suppurée, (2023-2026), Partner,
- NR PSDIFF (ANR-23-CE18-0037): Clostridioides difficile polysaccharides as therapeutic targets, (2024-2027), Coordinator,
- Industrial contract with BIOCODEX, Study of the impact of Saccharomyces boulardii CNCM I-745 on the biofilm of Clostridium difficile (2018-2022)
- Industrial contract PREVADIF with MSD, Seroprevalence of antibodies raised against surface antigens and toxins of Clostridioides difficile, (2021-2023)
- Industrial contract with EXELIOM, Preventive effect of Faecalibacterium prausnitzii in Clostrioides difficile infection (2023-2024)
- Industrial contract FIVADIF with TILLOTS PHARMA, Differential impact of Fidaxomycin and Vancomycin on early and late digestive clearance of Clostridioides difficile in infected patients (2024-2025)