- Filipe Carvalho, Alexis Carreaux, Anna Sartori-Rupp, Stéphane Tachon, Anastasia D. Gazi, Pascal Courtin, Pierre Nicolas, Florence Dubois-Brissonnet, Aurélien Barbotin, Emma Desgranges, Karine Gloux, Catherine Schouler, Rut Carballido-López, Marie-Pierre Chapot-Chartier, Eliane Milohanic, Hélène Bierne, Alessandro Pagliuso. Aquatic environment drives the emergence of cell wall-deficient dormant forms in Listeria. Nat Commun 2024 Oct 2;15:8499. doi: 10.1038/s41467-024-52633-7.
- Pourpre R, Lakisic G, Desgranges E, Cossart P, Pagliuso A, Bierne H. A bacterial virulence factor interacts with the splicing factor RBM5 and stimulate formation of RBM5 granules. Sci Rep. 2022 Dec 19;12(1):21961. doi: 10.1038/s41598-022-26037-w.
- Descoeudres N, Jouneau L, Henry C, Gorrichon K, Derré-Bobillot A, Serror P, Gillespie LL, Archambaud C, Pagliuso A, Bierne H. An immunomodulatory transcriptional signature associated with persistent Listeria infection in hepatocytes. Front Cell Infect Microbiol. 2021 Nov 10;11:761945. doi: 10.3389/fcimb.2021.761945. eCollection 2021.
- Pagliuso A, Tham TN, Allemand E, Robertin S, Dupuy B, Bertrand Q, Bécavin C, Koutero M, Najburg V, Nahori MA, Tangy F, Stavru F, Bessonov S, Dessen A, Muchardt C, Lebreton A, Komarova AV, Cossart P. AN RNA-binding protein secreted by a bactertial pathogen modulates RIG-I signaling. Cell Host Microbe. 2019 Dec 11;26(6):823-835.e11. doi: 10.1016/j.chom.2019.10.004
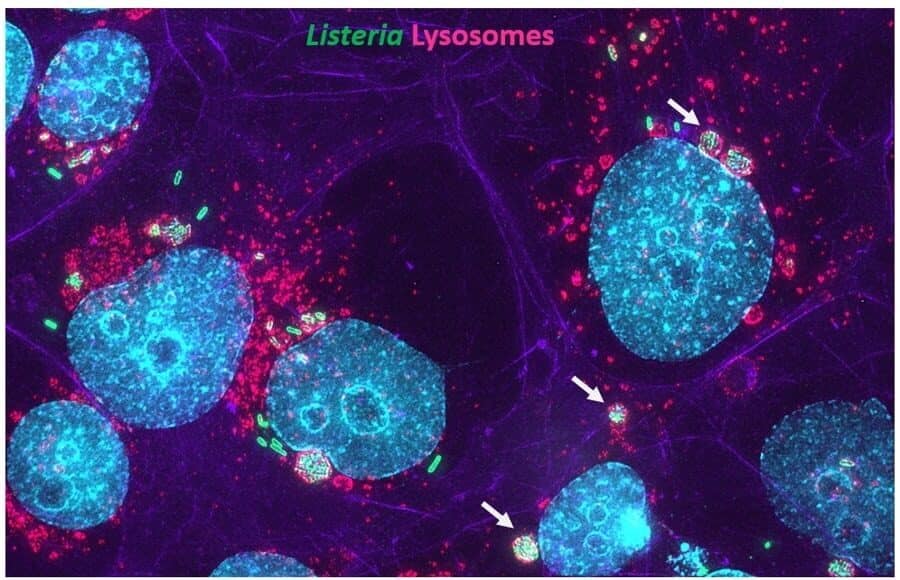
- Kortebi M, Milohanic E, Mitchell G, Péchoux C, Prevost MC, Cossart P, Bierne H. Listeria monocytogenes switches from dissemination to persistence by adopting a vacuolar lifestyle in epithelial cells. PLoS Pathog. 2017 Nov 30;13(11):e1006734. doi: 10.1371/journal.ppat.1006734.
Tous les articles de l’équipe sont disponibles dans la collection EPIMIC-MICALIS sur HAL.